���ʌ��f�Ƃ�
���N�Œ��������邽�߂ɁA������V���߁A�x�z����A���邢�͋��������ʌ��f�ɂ��čl���Ă݂܂��傤
�������ێ�������ʌ��f�̐����@�\�Ƒ��
![]()
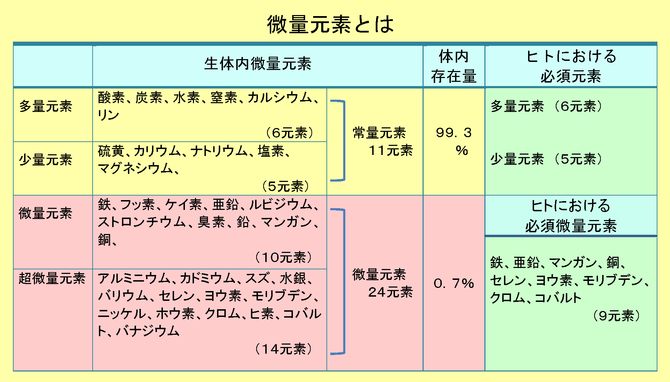
���݁A�n����Ŋm�F����Ă��錳�f�̑����͂P�P�W��ނɂ̂ڂ邪�A�M���������܂߁A�q�g�̑̂͂��ׂČ��f���琬�藧���Ă���B���̒��ŁA�A�~�m�_�A����ς����A�j�_�A���b�A���Ȃǂɗ��p����Ă���_�f�i�n�j�A�Y�f�i�b�j�A���f�i�g�j�A���f�i�m�j�A�J���V�E���i�b���j�A�����i�o�j�̂U��ނ̌��f�͑̓��Z�x�������A���ʌ��f�ƌĂ��B�U��ނ̌��f�����v����ƁA�l�̒��̑̓����ݗʂ͂X�W�D�T�����߂�B
�@���ɁA�������f�͗����i�r�j�A�J���E���i�j�j�A�i�g���E���i�m���j�A���f�i�b���j�A�}�O�l�V�E���i�l���j�ŁA�̓����ݗʂ͂O�D�O�T�`�O�D�Q�T���j���߁A���ʌ��f�ƌĂ��B
�@���ʌ��f�Ə��ʌ��f�����킹���P�P���f����ʌ��f�ƌĂсA���������v����Ɛl�̒��̑̓����ݗʂ͂X�X�D�R�����߂邱�ƂɂȂ�B
�@�������A�����P�P���f�����ł͐����Ȃ�тɌ��N���ێ����邱�Ƃ͏o���Ȃ��B�c��̂O�D�V���ɂ͔��ʂł͂��邪�A�����@�\���ێ������ŁA�ɂ߂ďd�v�Ȍ��f�ł�����ʌ��f�ƒ����ʌ��f���܂܂��B�S�i�e���j�A�t�b�f�i�e�j�A�P�C�f�i�r���j�A�����i�y���j�A�X�g�����`�E���i�r���j�A���r�W�E���i�q���j�A�L�f�i�a���j�A���i�o���j�A�}���K���i�l���j�A���i�b���j�̂P�O���f�͂������I�[�_�[�ő��݂��Ă���A���ʌ��f�ƌĂ��B����ɁA�������I�[�_�[�������݂��Ȃ������ʌ��f�ɂ̓A���~�j�E���i�`���j�A�J�h�~�E���i�b���j�A�X�Y�i�r���j�A�o���E���i�a���j�A����i�g���j�A�Z�����i�r���j�A���E�f�i�h�j�A�����u�f���i�l���j�A�j�b�P���i�m���j�A�z�E�f�i�a�j�A�N�����i�b���j�A�q�f�i�`���j�A�R�o���g�i�b���j�A�o�i�W�E���i�u�j�̂P�S��ނ�����B
�@�����Q�S��ނ̔��ʌ��f�̓��A�q�g�ɂƂ����K�{���ʌ��f essential trace elements �Ƃ��ĔF�߂��Ă�����̂͂e���A�y���A�l���A�b���A�r���A�h�A�l���A�b���A�b���̂X���f�ł���B�]���āA�q�g�ɂ�����K�{���f�͑��ʌ��f�A���ʌ��f�A���ʌ��f�����킹��ƂQ�O���f�ƂȂ�A�����̈ێ��A���̂̔���E�����A����Ȑ����@�\�ɂ͕s���̌��f�ł���B
�@���ɁA�������f�͗����i�r�j�A�J���E���i�j�j�A�i�g���E���i�m���j�A���f�i�b���j�A�}�O�l�V�E���i�l���j�ŁA�̓����ݗʂ͂O�D�O�T�`�O�D�Q�T���j���߁A���ʌ��f�ƌĂ��B
�@���ʌ��f�Ə��ʌ��f�����킹���P�P���f����ʌ��f�ƌĂсA���������v����Ɛl�̒��̑̓����ݗʂ͂X�X�D�R�����߂邱�ƂɂȂ�B
�@�������A�����P�P���f�����ł͐����Ȃ�тɌ��N���ێ����邱�Ƃ͏o���Ȃ��B�c��̂O�D�V���ɂ͔��ʂł͂��邪�A�����@�\���ێ������ŁA�ɂ߂ďd�v�Ȍ��f�ł�����ʌ��f�ƒ����ʌ��f���܂܂��B�S�i�e���j�A�t�b�f�i�e�j�A�P�C�f�i�r���j�A�����i�y���j�A�X�g�����`�E���i�r���j�A���r�W�E���i�q���j�A�L�f�i�a���j�A���i�o���j�A�}���K���i�l���j�A���i�b���j�̂P�O���f�͂������I�[�_�[�ő��݂��Ă���A���ʌ��f�ƌĂ��B����ɁA�������I�[�_�[�������݂��Ȃ������ʌ��f�ɂ̓A���~�j�E���i�`���j�A�J�h�~�E���i�b���j�A�X�Y�i�r���j�A�o���E���i�a���j�A����i�g���j�A�Z�����i�r���j�A���E�f�i�h�j�A�����u�f���i�l���j�A�j�b�P���i�m���j�A�z�E�f�i�a�j�A�N�����i�b���j�A�q�f�i�`���j�A�R�o���g�i�b���j�A�o�i�W�E���i�u�j�̂P�S��ނ�����B
�@�����Q�S��ނ̔��ʌ��f�̓��A�q�g�ɂƂ����K�{���ʌ��f essential trace elements �Ƃ��ĔF�߂��Ă�����̂͂e���A�y���A�l���A�b���A�r���A�h�A�l���A�b���A�b���̂X���f�ł���B�]���āA�q�g�ɂ�����K�{���f�͑��ʌ��f�A���ʌ��f�A���ʌ��f�����킹��ƂQ�O���f�ƂȂ�A�����̈ێ��A���̂̔���E�����A����Ȑ����@�\�ɂ͕s���̌��f�ł���B
![]()
�@���N�Ȑ��̂ł͑���ނ̌��f���l�X�ȔZ�x�ő��݂��A���̌��f�o�����X��ۂ��A����Ȑ����@�\�̈ێ��ɏd�v�Ȗ�����S���Ă���B���Ȃ킿�A��X�̔��ʌ��f�͐��̓��Ńo�����X�ǂ��ێ�����A�זE�̓����ƊO���̌��f�C�I���̔Z�x���ɂ߂Č����������I�œK�Z�x�͈� optimum concentration range �Ɉێ��E���߂���Ă���B��������ʌ��f�̃z���I�X�^�V�Xhomeostasis�i�P�퐫�j�Ƃ����B
�@�������A���̃o�����X�����R��ߏ�ɂ��j�]���A�P�퐫��������ƁA���茳�f�̉ߏ�~�ς⌇�R���U������A���ꂼ����L�̎��a���U�������B��ʓI�ɂ́A���ʌ��f�̊h���͉h�{��Q�␅�d�����ُ�Ƃ��Č���A���ʌ��f�̊h���͐��̓��̍y�f������������̋@�\��Q�Ƃ��Č����B
�@���ʌ��f�͓d�q�`�B�A�V�O�i���`�B�̂悤�Ȑ����@�\�̔����A�_���Ҍ��A�_�f���q�̉^���⒙���A���������̂悤�Ȑ��̐G�}�@�\�̔������邢�͈�`�q�����Ɋ֗^���邽��ς�����y�f�ɕK�v�s���Ȃ��̂ł���A�������R����Ɛ����w�I�Ɉُ픽���������N�����A��X�̎����̌����ƂȂ�B
�@�܂��A�t���ߏ��Ȍ��f�̐ێ�ɂ���Ă����f���L�̏d�ĂȎ��a�ɂȂ���B�Ƃ��ɁA�b����y���A�e���A�b���C�l���̂悤�ȑJ�ڌ��f�͍זE����ӂ�זE�����Ɋ֗^�����X�̍y�f�A�T�C�g�J�C���A�z�������Ȃǂ̊������S�ł�����A�����̊h���͂��ꂼ��̊������@�\��V�O�i���`�B�@�\�ւ̉e������Ĕ]�_�o�n�A�Ɖu�n�A������n�A������n�A�z��n�A�h�{��ӌn�Ȃǂ��܂��܂ȗ̈�̋@�\��Q��U������B
�@���ʌ��f�����������ɂ����ďd�v�ł��邱�Ƃ��F������n�߂��̂͂ق�̂P���I�قǑO�̂��Ƃł���B�ŏ��̂Q�T�N�͔����������͂̋Z�p�ɂ��q�g�̌��N�Ɖh�{�ɂ�����e���Ƃh�̌����Ɏn�܂邪�A���̌�̌��q�z�����́A���G�l���M�[�����킨��ь��q�F�i�����q���ˉ����́j��h�b�o�������́A�h�b�o���ʕ��͂Ȃǂ̕��͋Z�p�̐i���A���������̊J���Ƃ���ɂ��A�v���[�`�̋}���Ȑi�W�Ȃǂɂ���āA�b���A�l���A�y���A�l���A�r���A�b���A�b���̂悤�Ȕ��ʌ��f�̑g�D�A�זE�����x���ł̑�ӂ���I�d�v���A����ɂ͕K�{�������炩�ƂȂ��Ă����B���ʌ��f�̌��R�ǂ�ߏ�ǂɂ��ẮA�ȉ��̊e�_�Ɉς˂�B
�@���ʌ��f�̑����͂��̉��w�`���邢�͌����`����ё̑g�D�Ƒ̉t���̑��݈ʒu�ɉ����āA���܂��܂ȋ@�\�������Ă���B���̒��ł������I�Ȃ��̂Ƃ��āA�Ⴆ�h�Ƃb������������B���Ȃ킿�A���ꂼ��̌��f�����Ǝ��̋@�\�������ɂ��\�������P��̉������A�`���L�V���i�g�����[�h�`���j���j��r�^�~���a�P�Q�i�V�A�m�R�o���~���j�̋@�\���̂��̂f���Ă���B���������āA�`���L�V����r�^�~���a�P�Q�̂��܂��܂ȑ�Ӊߒ��ւ̊֗^�́A���Ȃ킿�h��b���̊֗^�Ƃ������ƂɂȂ�B
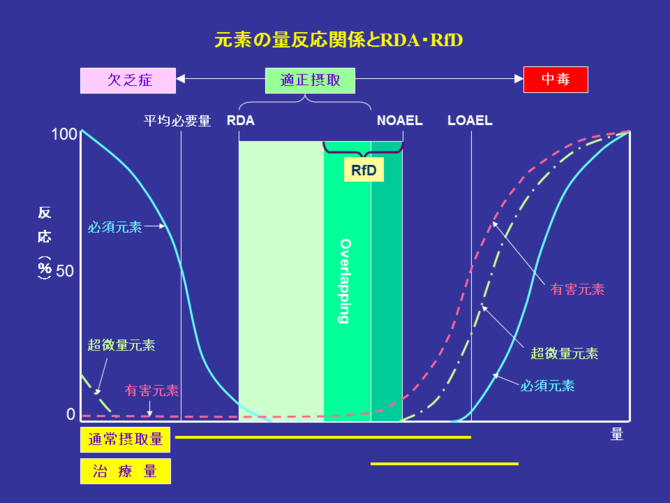
�@�g�D�̋@�\�エ��э\����̊��S����ۂ��A�����Ȃ�тɌ��N���ێ����邽�߂ɂ́A���ʌ��f�̋@�\�`�Ԃ���L�̔Z�x�͂��̎��K�͈͂��ێ����Ȃ���Ȃ�Ȃ��B����̔��ʌ��f�����R������A�o�����X�������Ă�����A�ߏ�Ɋ܂܂ꂽ�肵�Ă���H�a�𑱂��Đێ悷��ƁA�̑g�D���邢�͑̉t���̂��̌��f�̋@�\�`�ԁA�������邢�͔Z�x�̕ω���U�����A���̂��ߋ��e��������E�l����O��Ă��܂����ƂɂȂ�B���̂悤�ȏ̂��Ƃł́A�����w�I�Ȍ��ׂ������A�����@�\�ɉe��������A�\����ُ̈킪�N���邪�A���̗l���͌��f�̈Ⴂ�A�H�a���̌��R��Ő��̒��x�Ǝ������ԁA�N��A���ʂȂǂɂ���ĈقȂ�B
�@�X�̔��ʌ��f�̑�ӂ���I�@�\�̏ڍׂɂ��ẮA�ȉ��̊e�_�Ɉς˂邪�A�����I�@�\�ɂ��ẮA��q�̂悤�ɁA�q�g�ɂ�����K�{���f�͑��ʌ��f�A���ʌ��f�A���ʌ��f�����킹��ƂQ�O���f�ɂ��Ȃ�A���ꂼ��̌��f���Ǝ��̋@�\�����A�����̈ێ��A���̂̔���E�����A����Ȑ����@�\�ɂ͕s���̌��f�Ƃ��ďd�v�Ȗ����������Ă���B�q�g�K�{���ʌ��f�̎�Ȑ����@�\�ɂ��āA�\�ɂ܂Ƃ߂��̂ŁA�Q�Ƃ��ꂽ���B
�@�������A���̃o�����X�����R��ߏ�ɂ��j�]���A�P�퐫��������ƁA���茳�f�̉ߏ�~�ς⌇�R���U������A���ꂼ����L�̎��a���U�������B��ʓI�ɂ́A���ʌ��f�̊h���͉h�{��Q�␅�d�����ُ�Ƃ��Č���A���ʌ��f�̊h���͐��̓��̍y�f������������̋@�\��Q�Ƃ��Č����B
�@���ʌ��f�͓d�q�`�B�A�V�O�i���`�B�̂悤�Ȑ����@�\�̔����A�_���Ҍ��A�_�f���q�̉^���⒙���A���������̂悤�Ȑ��̐G�}�@�\�̔������邢�͈�`�q�����Ɋ֗^���邽��ς�����y�f�ɕK�v�s���Ȃ��̂ł���A�������R����Ɛ����w�I�Ɉُ픽���������N�����A��X�̎����̌����ƂȂ�B
�@�܂��A�t���ߏ��Ȍ��f�̐ێ�ɂ���Ă����f���L�̏d�ĂȎ��a�ɂȂ���B�Ƃ��ɁA�b����y���A�e���A�b���C�l���̂悤�ȑJ�ڌ��f�͍זE����ӂ�זE�����Ɋ֗^�����X�̍y�f�A�T�C�g�J�C���A�z�������Ȃǂ̊������S�ł�����A�����̊h���͂��ꂼ��̊������@�\��V�O�i���`�B�@�\�ւ̉e������Ĕ]�_�o�n�A�Ɖu�n�A������n�A������n�A�z��n�A�h�{��ӌn�Ȃǂ��܂��܂ȗ̈�̋@�\��Q��U������B
�@���ʌ��f�����������ɂ����ďd�v�ł��邱�Ƃ��F������n�߂��̂͂ق�̂P���I�قǑO�̂��Ƃł���B�ŏ��̂Q�T�N�͔����������͂̋Z�p�ɂ��q�g�̌��N�Ɖh�{�ɂ�����e���Ƃh�̌����Ɏn�܂邪�A���̌�̌��q�z�����́A���G�l���M�[�����킨��ь��q�F�i�����q���ˉ����́j��h�b�o�������́A�h�b�o���ʕ��͂Ȃǂ̕��͋Z�p�̐i���A���������̊J���Ƃ���ɂ��A�v���[�`�̋}���Ȑi�W�Ȃǂɂ���āA�b���A�l���A�y���A�l���A�r���A�b���A�b���̂悤�Ȕ��ʌ��f�̑g�D�A�זE�����x���ł̑�ӂ���I�d�v���A����ɂ͕K�{�������炩�ƂȂ��Ă����B���ʌ��f�̌��R�ǂ�ߏ�ǂɂ��ẮA�ȉ��̊e�_�Ɉς˂�B
�@���ʌ��f�̑����͂��̉��w�`���邢�͌����`����ё̑g�D�Ƒ̉t���̑��݈ʒu�ɉ����āA���܂��܂ȋ@�\�������Ă���B���̒��ł������I�Ȃ��̂Ƃ��āA�Ⴆ�h�Ƃb������������B���Ȃ킿�A���ꂼ��̌��f�����Ǝ��̋@�\�������ɂ��\�������P��̉������A�`���L�V���i�g�����[�h�`���j���j��r�^�~���a�P�Q�i�V�A�m�R�o���~���j�̋@�\���̂��̂f���Ă���B���������āA�`���L�V����r�^�~���a�P�Q�̂��܂��܂ȑ�Ӊߒ��ւ̊֗^�́A���Ȃ킿�h��b���̊֗^�Ƃ������ƂɂȂ�B
�@�g�D�̋@�\�エ��э\����̊��S����ۂ��A�����Ȃ�тɌ��N���ێ����邽�߂ɂ́A���ʌ��f�̋@�\�`�Ԃ���L�̔Z�x�͂��̎��K�͈͂��ێ����Ȃ���Ȃ�Ȃ��B����̔��ʌ��f�����R������A�o�����X�������Ă�����A�ߏ�Ɋ܂܂ꂽ�肵�Ă���H�a�𑱂��Đێ悷��ƁA�̑g�D���邢�͑̉t���̂��̌��f�̋@�\�`�ԁA�������邢�͔Z�x�̕ω���U�����A���̂��ߋ��e��������E�l����O��Ă��܂����ƂɂȂ�B���̂悤�ȏ̂��Ƃł́A�����w�I�Ȍ��ׂ������A�����@�\�ɉe��������A�\����ُ̈킪�N���邪�A���̗l���͌��f�̈Ⴂ�A�H�a���̌��R��Ő��̒��x�Ǝ������ԁA�N��A���ʂȂǂɂ���ĈقȂ�B
�@�X�̔��ʌ��f�̑�ӂ���I�@�\�̏ڍׂɂ��ẮA�ȉ��̊e�_�Ɉς˂邪�A�����I�@�\�ɂ��ẮA��q�̂悤�ɁA�q�g�ɂ�����K�{���f�͑��ʌ��f�A���ʌ��f�A���ʌ��f�����킹��ƂQ�O���f�ɂ��Ȃ�A���ꂼ��̌��f���Ǝ��̋@�\�����A�����̈ێ��A���̂̔���E�����A����Ȑ����@�\�ɂ͕s���̌��f�Ƃ��ďd�v�Ȗ����������Ă���B�q�g�K�{���ʌ��f�̎�Ȑ����@�\�ɂ��āA�\�ɂ܂Ƃ߂��̂ŁA�Q�Ƃ��ꂽ���B
| ���f | ��Ȑ����@�\ |
| �S �e�� |
�啔���̂e���̓^���p�N���ƌ������đ��݂��A���̖�U�T�����w���O���r���Ƃ��āA��P�T�`�R�O�����t�F���`���A�w���V�f�����Ƃ��āA��T�����ؓ����Ƀ~�I�O���r���Ƃ��đ��݁B�_�f�����A�_�f�^���A�d�q�`�B�A���̃G�l���M�[�����Ȃǂ̐����@�\�̈ێ��ɂ������w���^���p�N���ɕK�{�B�זE����ӂ�זE�����Ɋ֗^�����X�̍y�f�A�T�C�g�J�C���A�z�������Ȃǂ̊������S�Ƃ��Ċ������@�\��V�O�i���`�B�@�\�ɏd�v�B�X�[�p�[�I�L�V�h�W�X���^�[�[�i�r�n�c�j�A�J�^���[�[�Ȃǂ̍R�_���y�f�̍\�������B |
| ���� �y�� |
�O���B�ɍ��Z�x�ɑ��݁B�Z�x�~���ɁA���A�t�A�A�́A�S���A�����ǁA�]�A�ΊہA�����B�R�O�O��ȏ�̍y�f�A�T�C�g�J�C���A�z�������Ȃǂ̊������S�B�y���z���I�X�^�V�X�̊h���A�Ƃ��ɂy�����R�͍זE����ӂ�זE�����Ɋ֗^���邻�ꂼ��̊������@�\��V�O�i���`�B�@�\�ւ̉e������Ĕ]�_�o�n�A�Ɖu�n�A������n�A������n�A�z��n�A�h�{��ӌn�Ȃǂ��܂��܂ȗ̈�̋@�\��Q��U���B��V���̌��R�ǂƂ��Đ�V���������[�畆������B�W�I�y�f�F�A���J���z�X�t�@�^�[�[�A�|�������[�[�A�y�v�`�_�[�[�A�r�n�c |
| �� �b�� |
�b���̑�ӂɂ������v����͊̑��ł���A��v��ӌo�H�͒_�`�n�ł���B�b���͌����A���u�~���ƌ������A�́A�t�ŃZ�����v���X�~���Ɏ�荞�܂�A�̑��ɒB�����b���͒_�`���ɕ��傳��A�_�njo�H���o�ĕ����ɔr���B�́A�t�ɍ��Z�x�ɑ��݂��邪�A������ِ��͂Ȃ��B�b���C�I���͊e��̎_���Ҍ��y�f�̕���q�Ƃ��Ď�X�̐�����p�ɋ@�\�B�_�f�^���A�d�q�`�B�Ȃǂ̐����@�\�̈ێ��ɂ������b���y�f�̊������@�\�Ɋ֗^�B�b�����R�̓Z�����v���X�~���A�V�g�N�����b�_���y�f�A���V���_���y�f�A�`���V�i�[�[�̊����ቺ��U���B��V���̌��R�ǂƂ��ă����P�X�a�A�ߏ�ǂƂ��ăE�C���\���a����B |
| �}���K�� �l�� |
�l���̓g�����X�t�F�����ƌ������A���t�z�ɂ�肷�݂₩�Ɋe����֗A������A�̑����o�R���Ē_�`�Ɉڍs���A�قƂ�ǑS�������Ǖǂ�蕳�ւɔr���B�́A�t�A�]�����́A�b��B�A���t�A�������Ȃǂɑ��܁B�זE���ł̂l���̓~�g�R���h���A�ɋǍ݁B���V���ߒ��̃s���r���_�J���{�L�V���[�[�A���`�����̃v���e�I�O���J�������ɏd�v�ȃO���R�V���g�����X�t�F���[�[�A�R�_����p�����X�[�p�[�I�L�V�h�W�X���^�[�[�i�r�n�c�j�Ȃǂ̋����y�f�̕⌇���q�Ƃ��ċ@�\�B�b����o�ɂ��l����Ӂi�z���A�����j�̖W�Q�B |
| �Z���� �r�� |
�ێ悵���r���̑̓����Ԃ͂r���̉h�{��Ԃɂ��ω�����B�r���[����Ԃł͊́A�t�ɒ~�ς�����A���݂₩�ɔr���B�r�����R��Ԃł͐����A�b��B�ȂǓ�����튯�ɗD��I�ɕ��z�B���̓��ɋz�����ꂽ�r���������͍ŏI�I�ɃZ���i�C�h�ɑ�ӂ���A�r���ܗL�^���p�N���Ɏ�荞�܂�A�Z���m�V�X�e�C���Ƃ��đ��݁B�r���̓O���^�`�I���y���I�L�V�_�[�[��`�I���h�L�V���Ҍ��y�f�Ȃǂ̍R�_���y�f�A���邢�͍b��B�z�������i�`���L�V���j�̑�Ӂi�s�S����s�R�ɕϊ�����j�ɕK�v�ȒE���[�h���y�f�̍\�������B�r�����R�͐S�؏ǂ�U���i�����E���R�a�j�B�r���ߏ�͐_�o�Ǐ�A�ݒ���Q�A������Q�A�܂̕ϐF�ƒE���A�E�тȂǂ̏Ǐ��U���B |
| �N���� �b�� |
��������z�����ꂽ�b��⁶⁺�͐Ԍ�������ʉ߂��A�Ԍ������łb��³⁺�ɊҌ�����ăw���O���r���ƌ����B�b��³⁺�͐Ԍ�������ʉ߂ł����A�������̃A���u�~����g�����X�t�F�����ƌ������A��v�ȑ�ӑ���ł���́A�t�։^�������B�q�g�ł͂U�O�`�V�O�����A���u�~���A�R�O�`�S�O�����g�����X�t�F�����ƌ����B�����I�����͓���Ӂi�b���ܗL�ϓ����q�j�A�R���X�e���[����ӁA�����D��Ӂi�R���[�Q���`����cross-linking�j�A�^���p�N����ӂȂǂւ̊֗^�B �b�����R�͑ϓ��\�ُ�A������Q�A�Z���A�����E����ς�����ӈُ�A�p�������A�����d���Ȃǂ�U���B�̓����z�͐l��A�n�捷�A�N��A�H�K���A�������ɂ��ϓ��B�o�����A�́A�t�A�x�A�S���ɑ��܂��邪�A����Ƌ��Ɍ����B |
| �R�o���g �b�� |
�b��²⁺�܂��͂b��³⁺�̏�ԂŒ��ǂ���z������A���܂��܂ȑg�D�ɕ��z���邪�A�́A�t�A���ɔ�r�I���܁B�r�^�~���a�P�Q�i�V�A�m�R�o���~���j�Ƃ��Đ_�o�g�D�̌��N�ێ��A�Ԍ�����j�_�̍����ɕK�v�B�b�����R�͈����n���A���`���}�����_�A�A�H�~���ށi���킸�a�j�A�̏d�����Ȃǂ�U���B�����n���ł͐Ԍ��������A����ԉ苅�o���B |
| �����u�f�� �l�� |
�����u�f�[�g�C�I���i�l���n₄²⁻�j�̌`�ŋz������A�����Ɍ����ɓ���A�P���ŔA�ɔr���B�́A�t�A�B�A�x�A�]�A�ؓ��ɑ��݁B�̓��l���̂قƂ�ǂ̓A�~�m�_��Ӎy�f�A�j�_��Ӎy�f�A���_��Ӎy�f�Ȃǂ̍y�f�̊������S�Ƃ��đ��݁B�����⎉���̑�ӂ������A�n����\�h�B�l�����R�͑���A�����S�����A���S�A�q�f�A�������o�̑r���A�����Ȃǂ̏Ǐ��U���B�H������̌��R�͂Ȃ��B�̂ɑ��܂̃A���f�q�h�_���y�f�A�����_�_���y�f�A�L�T���`���_���y�f�Ȃǂ̊������S�ł�����B�b���Ɲh�R�i�r�n₄�Ƃl���ɂ��b����ӂ̖W�Q�j�B |
| ���E�f �h |
�ێ悳�ꂽ�h�C�I���͍b��B�A���t�B�A�ݑB�ŔZ�k����A���t���̃v�[�����疈���ێ�ʂ̂Q�O���i�V�O�`�W�O㎍�j�̂h�C�I�����b��B�Ɏ�荞�܂��B�b��B���Ɏ�荞�܂ꂽ�h�C�I���̓`���V�����q�ƌ������A�قƂ�ǂ����[�h�`���j���̌`�ő��݂���B����l�b��B�ɑ��݂��郈�E�����̊����̓��m���[�h�`���V���i�l�h�c�j���Q�R���A�W���[�h�`���V���i�c�h�s�j���R�R���A�`���L�V���i�s₄�j���R�T���A�R�A�T�A�T�e�|�g�����[�h�`���j���i�s₃�j���V���ł���B�s₃�A�s₄�Ƃ��b��B�z�������̍�p�������A�V���^�̂s₃�̕����R�`�T�{�����������B�b��B�̐����͓Ǝ��̍�p�����h�C�I���̑�ӁE�������̂��̂ł���B���l�̂h�̑̓����ʂ͂Q�O�r�ł���A���̂W�O�����b��B�ɂ���i���̑g�D�Z�x�̖�P���{�j�A�����Ŋ́A�x�A�����A���t�A�ؓ��ɑ��݁B�_�f����E�M�Y���̑����A�A�h���i�����̍�p�����A�����z�������̍������i�A�_�o�זE�̕��听�n��U���A����ӂ̈ێ��A�]�����̂s�r�g�̕���}���Ȃǂ̐����@�\����B�h���R�َ͑��E�V�������̃N���`���a�A�c�����̌Q���@�\�ቺ�ǁA���l�̔S�t����i����x���A�畆�����j�A�R���C�h�b��B��A�n���a�����b��B��Ȃǂ�U���B�b��B�z���������R�Ƃ��ẮA��b��Ӓቺ�A������Q��U���B |
![]()
�@��ӂɂ��ẮA�z���A�̓��ł̕��z�A�r���Ȃǂ̖ʂ���l�@����Ă���B���̒��ŁA���ʌ��f�̋z���́A�h�呤�̔N��A���N��ԁA�ݒ��Ǔ��̏�ԁA�ێ悠�邢�͓��^���ꂽ���f�i���邢�͐H�a���̌��f�j�̉��w�`�ԁA�H�a���ɋ�������z���C�����q�Ȃǂɂ��傫���e������B�z�����ʂ̑唼�͈ݒ��ǂ���̋z���ł��邪�A�e���A�b���A�y���Ȃǂł͏����Ƃ��ɏ\��w���ł���B�������A���ꂼ��̔��ʌ��f�̋z���@�\�ɂ��Ă͂e����b���Ȃǂ̈ꕔ�̎�Ȍ��f�������A�قƂ�lj𖾂���Ă��Ȃ��B
�@���ʌ��f�̑̓��ł̕��z�ɂ��ẮA�X�̌��f�ɂ����ĕW�I���킪�قȂ�A���ꂼ���������̓����z�������B
�@�Ⴆ�A�z�����ꂽ�e�� �̑啔���́A��X�̑�ӌo�H���o�đ̓��֘A���I�ɕ��z���Ă䂭�B�����̌o�H�̒��ŁA�����\�Ԍ����\�V�����Ԍ����\�����̌o�H���ł��傫�Ȋ������߂�B���Ȃ킿�A�����ǂ���z�����ꂽ�����̂e���̓g�����X�t�F�����ƌ������A���t�z�ɂ��e����֗A�������B�g�D�����z�Ƃ��ẮA��U�T�����w���O���r���Ƃ��đ��݂��Ă���̂ŁA�����ɊW���鑟��ɑ����B
�@�b�� �̑�ӂɂ������v����͊̑��ł���A��v��ӌo�H�͒_�`�n�ł���B���Ȃ킿�A������z�����ꌌ�t�ɓ������b���͌����A���u�~���ƌ������A�b���|�A���u�~���̌������������A�́A�t�֗A�����ꂽ��A�����̑���ŃZ�����v���X�~���Ɏ�荞�܂�A�Ăь������Ɋ܂܂�A�e�g�D�֍L�����z���邪�A��v����ł���̑��ɒB�����b���́A�~�g�R���h���A�A�~�N���]�[���A�j�A�n������Ɏ�荞�܂��B�̑����̂b���͒_�`���ɕ��傳��A�_�njo�H���o�Ĕr������A���������̂Ƃ���ɖ߂�B�g�D�����z�Ƃ��ẮA�́A�t�ɑ������A������ِ��͂Ȃ��B
�@�z�����ꂽ�y�� �́A���܂��܂ȑg�D�ɂ��ꂼ��قȂ������x�Ŏ�荞�܂��B����͑g�D���Ƃɂy���̌�֓x���قȂ邱�Ƃ������Ă���B�y���̏W�ϑ��x����ь�֓x�̍ł������̂́A�X�A�́A�t�A�B���ł���B���⒆���_�o�n�ւ̂y���̎�荞�݂͔�r�I�x�����A���������荞�܂��Ƌ��łɌ������Ē����ԑؗ�����B���풆�A�y���Z�x�̍ł������̂͑O���B�ł���A�~���ɁA���A�t�A�A�́A�S���A�����ǁA�]�A�ΊہA�����ł���B
�@�y���̑�ӌo�H�̓��ِ��́A���˂ɂ��y���������Ȃy���z���̖W�Q�ɂ��y���z���I�X�^�V�X���e�ՂɊh������邱�Ƃł���B���Ȃ킿�A�y���̋z����r���̏�ō�p���Ă���y����ӂ̍P��I����́A�z���Ɣr���̗��@�\���ꏏ�ɋ@�\���Ă���ꍇ�ɂ̂ݍ쓮����Ƃ�����B
�@�܂��A�z�����ꂽ�l�� �̓g�����X�t�F�����ƌ������A���t�z�ɂ�肷�݂₩�Ɋe����֗A�������B�̏z�ɓ������l���͂Ƃ��Ɋ̑��֑�����荞�܂�A�����Ɋ̑����o�R���Ē_�`�ɏo�����A�قƂ�ǑS�������Ǖǂ�蕳�ւɔr������邪�A�g�D�̊ԂōĔz�������B���t����̏����Ɗ̑��ւ̎�荞�݂̓��I�p�^�[���������ł��邱�Ƃ���A�̓��̂l���̑啔���͓��I�ȁA���ɗ����I�ȏ�Ԃɂ���A���t���̂l���Ɗ̑��̃~�g�R���h���A�̂l���͋}���ɕ��t�ɒB���Ă��邱�Ƃ�������B
�@�g�D�����z�Ƃ��ẮA�́A�t�A�]�����́A�b��B�A���t�A�������Ȃǂɑ����܂܂��B�זE���ł̂l���̓~�g�R���h���A�ɋǍ݂��A�~�g�R���h���A�ł̌�֓x�������B�j�ł̌�֓x�͒Ⴂ�B
�@�ŋ߁A���ʌ��f�̗A���ɂ������^���p�N���̑��݂����炩�ƂȂ�A���ʌ��f�̍זE���ɂ�����ڍׂȒ��ߋ@�\�����炩�ƂȂ��ė��Ă���B�Ⴆ�A�y����b���ɑ���A���u�~���A�b���ɑ���Z�����v���X�~���A�e���ɑ���g�����X�t�F�����Ȃǂ͌��t�z�ɂ��e���������A����������A������ς����ł���A���ʌ��f�̍P�퐫���ێ����鐶�̋@�\���q�Ƃ��Ă悭�m���Ă���B�����āA�זE���O�ɂ�����A���^���p�N���Ƃ��ẮA�y���ɑ���X��ނ̂y���g�����X�|�[�^�[�t�@�~���[�iZnT family�j��P�S��ނ�Zip�t�@�~���[�A�b���ɑ���b���g�����X�|�[�^�[�iCtr1�j�AAtox1-ATP7/ATP7B�ACCS-Cu/Zn SOD�CCox17-CCO�A�e���ɑ���g�����X�t�F�����|�g�����X�t�F�������Z�v�^�[�iTf-TfR�j�ADMT1�AFerroportin1�Ȃǂ̑��݂����o����Ă���B
�@���ʌ��f�̑̓��ł̕��z�ɂ��ẮA�X�̌��f�ɂ����ĕW�I���킪�قȂ�A���ꂼ���������̓����z�������B
�@�Ⴆ�A�z�����ꂽ�e�� �̑啔���́A��X�̑�ӌo�H���o�đ̓��֘A���I�ɕ��z���Ă䂭�B�����̌o�H�̒��ŁA�����\�Ԍ����\�V�����Ԍ����\�����̌o�H���ł��傫�Ȋ������߂�B���Ȃ킿�A�����ǂ���z�����ꂽ�����̂e���̓g�����X�t�F�����ƌ������A���t�z�ɂ��e����֗A�������B�g�D�����z�Ƃ��ẮA��U�T�����w���O���r���Ƃ��đ��݂��Ă���̂ŁA�����ɊW���鑟��ɑ����B
�@�b�� �̑�ӂɂ������v����͊̑��ł���A��v��ӌo�H�͒_�`�n�ł���B���Ȃ킿�A������z�����ꌌ�t�ɓ������b���͌����A���u�~���ƌ������A�b���|�A���u�~���̌������������A�́A�t�֗A�����ꂽ��A�����̑���ŃZ�����v���X�~���Ɏ�荞�܂�A�Ăь������Ɋ܂܂�A�e�g�D�֍L�����z���邪�A��v����ł���̑��ɒB�����b���́A�~�g�R���h���A�A�~�N���]�[���A�j�A�n������Ɏ�荞�܂��B�̑����̂b���͒_�`���ɕ��傳��A�_�njo�H���o�Ĕr������A���������̂Ƃ���ɖ߂�B�g�D�����z�Ƃ��ẮA�́A�t�ɑ������A������ِ��͂Ȃ��B
�@�z�����ꂽ�y�� �́A���܂��܂ȑg�D�ɂ��ꂼ��قȂ������x�Ŏ�荞�܂��B����͑g�D���Ƃɂy���̌�֓x���قȂ邱�Ƃ������Ă���B�y���̏W�ϑ��x����ь�֓x�̍ł������̂́A�X�A�́A�t�A�B���ł���B���⒆���_�o�n�ւ̂y���̎�荞�݂͔�r�I�x�����A���������荞�܂��Ƌ��łɌ������Ē����ԑؗ�����B���풆�A�y���Z�x�̍ł������̂͑O���B�ł���A�~���ɁA���A�t�A�A�́A�S���A�����ǁA�]�A�ΊہA�����ł���B
�@�y���̑�ӌo�H�̓��ِ��́A���˂ɂ��y���������Ȃy���z���̖W�Q�ɂ��y���z���I�X�^�V�X���e�ՂɊh������邱�Ƃł���B���Ȃ킿�A�y���̋z����r���̏�ō�p���Ă���y����ӂ̍P��I����́A�z���Ɣr���̗��@�\���ꏏ�ɋ@�\���Ă���ꍇ�ɂ̂ݍ쓮����Ƃ�����B
�@�܂��A�z�����ꂽ�l�� �̓g�����X�t�F�����ƌ������A���t�z�ɂ�肷�݂₩�Ɋe����֗A�������B�̏z�ɓ������l���͂Ƃ��Ɋ̑��֑�����荞�܂�A�����Ɋ̑����o�R���Ē_�`�ɏo�����A�قƂ�ǑS�������Ǖǂ�蕳�ւɔr������邪�A�g�D�̊ԂōĔz�������B���t����̏����Ɗ̑��ւ̎�荞�݂̓��I�p�^�[���������ł��邱�Ƃ���A�̓��̂l���̑啔���͓��I�ȁA���ɗ����I�ȏ�Ԃɂ���A���t���̂l���Ɗ̑��̃~�g�R���h���A�̂l���͋}���ɕ��t�ɒB���Ă��邱�Ƃ�������B
�@�g�D�����z�Ƃ��ẮA�́A�t�A�]�����́A�b��B�A���t�A�������Ȃǂɑ����܂܂��B�זE���ł̂l���̓~�g�R���h���A�ɋǍ݂��A�~�g�R���h���A�ł̌�֓x�������B�j�ł̌�֓x�͒Ⴂ�B
�@�ŋ߁A���ʌ��f�̗A���ɂ������^���p�N���̑��݂����炩�ƂȂ�A���ʌ��f�̍זE���ɂ�����ڍׂȒ��ߋ@�\�����炩�ƂȂ��ė��Ă���B�Ⴆ�A�y����b���ɑ���A���u�~���A�b���ɑ���Z�����v���X�~���A�e���ɑ���g�����X�t�F�����Ȃǂ͌��t�z�ɂ��e���������A����������A������ς����ł���A���ʌ��f�̍P�퐫���ێ����鐶�̋@�\���q�Ƃ��Ă悭�m���Ă���B�����āA�זE���O�ɂ�����A���^���p�N���Ƃ��ẮA�y���ɑ���X��ނ̂y���g�����X�|�[�^�[�t�@�~���[�iZnT family�j��P�S��ނ�Zip�t�@�~���[�A�b���ɑ���b���g�����X�|�[�^�[�iCtr1�j�AAtox1-ATP7/ATP7B�ACCS-Cu/Zn SOD�CCox17-CCO�A�e���ɑ���g�����X�t�F�����|�g�����X�t�F�������Z�v�^�[�iTf-TfR�j�ADMT1�AFerroportin1�Ȃǂ̑��݂����o����Ă���B
![]()
�@���ʌ��f�̔r���ɂ��ẮA�X�̌��f�ɂ����ĈقȂ�A���ꂼ���������r���������B�Ⴆ�A�e�� �̔A�╳���Ɍ����ʂ͋ɂ߂ď��Ȃ��A�̂��e����r�o����\�͂ɂ͌��E������B�����ɔr�����ꂽ�e���̂قƂ�ǂ͋z������Ȃ������H�����̂e���ł���B�^�̔r���e���́A���������זE����ђ_�`�ɗR��������̂ł���A�_�`���ɑ��݂���e���͎�Ƃ��ăw���O���r���̕����ɂ����̂ł���B�܂��A�A�╳����̂e���̔r���ɉ����Ċ���сA�܁A�畆������A���I�ɂe����������B
�@�ێ悳�ꂽ�b�� �̑����͊̑�����_�`�n���o�R���A�����Ɍ����B���̂قƂ�ǂ͒ʏ�z������Ȃ��b���ł���B�܂��A�������ʂ̂b�������ڌ�������A���ɁA���邢�͒��ǂ�ʂ��Ĕr�������B�̑��\�_�`������\�_�njo�H�\���ǂ��o�R����_�`�n�r�����b���̎�v�r���o�H�ł���B
�@�ێ悳�ꂽ�y�� �͑啔�����ւƂ��đ̊O�ɔr�������B�����̂y���͑啔�����z���̐H�a���̂y���ŁA�̓�����ɗR������y���͂킸���ł���B�̓��̂y���͎���X�t���o�ď����֔r�������B�܂��A�������ʂ̂y�����_�`�A�Ӓ�����ь������ɕ��傳���B�A���ւ̔r���͋ɂ߂ď��Ȃ��B
�@�ێ悳�ꂽ�l�� �͂����ɒ_�`�ɏo�����A����̌o�H�����ǂ�A�قƂ�ǑS�������Ǖǂ�蕳�ւɔr�������B���̔r�����߂��A�z�����߂����A�l���Z�x�߂���L���ȁA�P�퐫��ۂ��߂̋@�\�Ƃ��ē����B���Ȃ킿�A�_�`���l���̎�v�r���o�H�ł���A��v�Ȓ��ߋ@�\�ł���B�_�njo�H�j�Q�Ȃǂłl���̒��̏z���ߕ��ׂŖO�a�����ꍇ�́A���̒��ߎ�i����єr���ߒ��Ƃ����X�t����̔r�������傷��B���펞�̔A���ւ̔r���͔��ɂ킸���ł���B
�X�̔��ʌ��f�̑�ӂ���I�@�\�̏ڍׂɂ��ẮA���̍��̊e�_���Q�Ƃ��ꂽ���B
�@�ێ悳�ꂽ�b�� �̑����͊̑�����_�`�n���o�R���A�����Ɍ����B���̂قƂ�ǂ͒ʏ�z������Ȃ��b���ł���B�܂��A�������ʂ̂b�������ڌ�������A���ɁA���邢�͒��ǂ�ʂ��Ĕr�������B�̑��\�_�`������\�_�njo�H�\���ǂ��o�R����_�`�n�r�����b���̎�v�r���o�H�ł���B
�@�ێ悳�ꂽ�y�� �͑啔�����ւƂ��đ̊O�ɔr�������B�����̂y���͑啔�����z���̐H�a���̂y���ŁA�̓�����ɗR������y���͂킸���ł���B�̓��̂y���͎���X�t���o�ď����֔r�������B�܂��A�������ʂ̂y�����_�`�A�Ӓ�����ь������ɕ��傳���B�A���ւ̔r���͋ɂ߂ď��Ȃ��B
�@�ێ悳�ꂽ�l�� �͂����ɒ_�`�ɏo�����A����̌o�H�����ǂ�A�قƂ�ǑS�������Ǖǂ�蕳�ւɔr�������B���̔r�����߂��A�z�����߂����A�l���Z�x�߂���L���ȁA�P�퐫��ۂ��߂̋@�\�Ƃ��ē����B���Ȃ킿�A�_�`���l���̎�v�r���o�H�ł���A��v�Ȓ��ߋ@�\�ł���B�_�njo�H�j�Q�Ȃǂłl���̒��̏z���ߕ��ׂŖO�a�����ꍇ�́A���̒��ߎ�i����єr���ߒ��Ƃ����X�t����̔r�������傷��B���펞�̔A���ւ̔r���͔��ɂ킸���ł���B
�X�̔��ʌ��f�̑�ӂ���I�@�\�̏ڍׂɂ��ẮA���̍��̊e�_���Q�Ƃ��ꂽ���B
���������������ʌ��f
![]()
���ʌ��f�͂��ꂼ�ꂪ���@�\�ɏ]���Ĉ��̌��f�o�����X��ۂ��C����Ȑ����@�\�����Ă��邪�C���̃o�����X���j�]����Ƃ��ꂼ����L�̎�����U������D
�y���z���I�X�^�V�X�̊h���C�Ƃ����y�����R�͍זE����ӂ�זE�����Ɋ֗^���邻�ꂼ��̊������@�\��V�O�i���`�B�@�\�ւ̉e������Ĕ]�_�o�n�C�Ɖu�n�C������n�C������n�C�z��n�C�h�{��ӌn�Ȃǂ��܂��܂ȗ̈�̋@�\��Q��U�����D����ɖ��o��Q�C�k�o��Q�C�畆��Q�C�є��̒E���C������Q�C�Ɖu�@�\��Q�C�L���w�K��Q�Ȃǂ̔]�_�o�@�\��Q�C��X�̐��z�����������Q�Ȃǂ̐��B��Q�Ȃǂ�U������D��V���̌��R�ǂƂ��Ă͐�V���������[�畆���Ȃǂ���������D
�e�����R�́C�n���C��J���C���ӊ��C��E���o�E�݁E�܁E�є��Ȃǂ̑g�D�ُ�C�����ł͐H�~�s�U�C����s�ǂ�U������D�e���ߏ��ł́C�w���V�f���[�V�X�͂e�������`�����̃w���V�f�������g�D�������邪�@�\��Q�͂Ȃ��C����C�w���N���}�g�[�V�X�͊̑��C�X���C�S���C�����́C���B�̑���זE�ɂe���������C�����Q���N�����D�Ƃ��ɂe���ߏ�́C�_���X�g���X�̌n�Ńt�F���g���������ɂ�芈���_�f�����𑣐i���C�����i�ɓ����D
�b�����R�́C�Z�����v���X�~���C�`�g�N�����b�_���y�f�C���V���_���y�f�C�`���V�i�[�[�̊����ቺ��U�����C�n���C�S���⓮���ُ�C�]�_�o��Q��F�f�ُ�������N�����D��V���̌��R�ǂƂ��ă����P�X�a������C�сC���C��C���ǂȂǂُ̈�C�z���C�ؓ��ْ��͂̒ቺ�C�m�\��g�̔���̒x���Ȃǂ𗈂��D����́C�S���W�̖���ɂ���b���A���`�����icopper transporting P-type ATPase�j�̈�`�q�ُ�ŁC�b���̋z���j�Q��A����Q�ɂ��זE���b���̌��R�C�t�ւ̂b���~�ς��v���Ƃ����D�b���ߏ��ł́C�}���I�ɂ͚q�f�C�����C�㕠���ɁC�d�ǂɂȂ�Ɨn�����n����z���E���N�������S���邱�Ƃ�����D����ł̂b�������͔x�ł̓����`���C���ۉ���̑��ł̊̉��C�̍d�ς�U������D��`���b����ӈُ�Ƃ��āC�g�D�ɂb�����������C��X�̏�Q��U������E�C���\���a������D
�y���z���I�X�^�V�X�̊h���C�Ƃ����y�����R�͍זE����ӂ�זE�����Ɋ֗^���邻�ꂼ��̊������@�\��V�O�i���`�B�@�\�ւ̉e������Ĕ]�_�o�n�C�Ɖu�n�C������n�C������n�C�z��n�C�h�{��ӌn�Ȃǂ��܂��܂ȗ̈�̋@�\��Q��U�����D����ɖ��o��Q�C�k�o��Q�C�畆��Q�C�є��̒E���C������Q�C�Ɖu�@�\��Q�C�L���w�K��Q�Ȃǂ̔]�_�o�@�\��Q�C��X�̐��z�����������Q�Ȃǂ̐��B��Q�Ȃǂ�U������D��V���̌��R�ǂƂ��Ă͐�V���������[�畆���Ȃǂ���������D
�e�����R�́C�n���C��J���C���ӊ��C��E���o�E�݁E�܁E�є��Ȃǂ̑g�D�ُ�C�����ł͐H�~�s�U�C����s�ǂ�U������D�e���ߏ��ł́C�w���V�f���[�V�X�͂e�������`�����̃w���V�f�������g�D�������邪�@�\��Q�͂Ȃ��C����C�w���N���}�g�[�V�X�͊̑��C�X���C�S���C�����́C���B�̑���זE�ɂe���������C�����Q���N�����D�Ƃ��ɂe���ߏ�́C�_���X�g���X�̌n�Ńt�F���g���������ɂ�芈���_�f�����𑣐i���C�����i�ɓ����D
�b�����R�́C�Z�����v���X�~���C�`�g�N�����b�_���y�f�C���V���_���y�f�C�`���V�i�[�[�̊����ቺ��U�����C�n���C�S���⓮���ُ�C�]�_�o��Q��F�f�ُ�������N�����D��V���̌��R�ǂƂ��ă����P�X�a������C�сC���C��C���ǂȂǂُ̈�C�z���C�ؓ��ْ��͂̒ቺ�C�m�\��g�̔���̒x���Ȃǂ𗈂��D����́C�S���W�̖���ɂ���b���A���`�����icopper transporting P-type ATPase�j�̈�`�q�ُ�ŁC�b���̋z���j�Q��A����Q�ɂ��זE���b���̌��R�C�t�ւ̂b���~�ς��v���Ƃ����D�b���ߏ��ł́C�}���I�ɂ͚q�f�C�����C�㕠���ɁC�d�ǂɂȂ�Ɨn�����n����z���E���N�������S���邱�Ƃ�����D����ł̂b�������͔x�ł̓����`���C���ۉ���̑��ł̊̉��C�̍d�ς�U������D��`���b����ӈُ�Ƃ��āC�g�D�ɂb�����������C��X�̏�Q��U������E�C���\���a������D

![]()
![]()
![]()








![�]�_�o�@�\�Ɣ��ʌ��f �]�_�o�@�\�Ɣ��ʌ��f](dataimge/1499133990_1.jpg)









